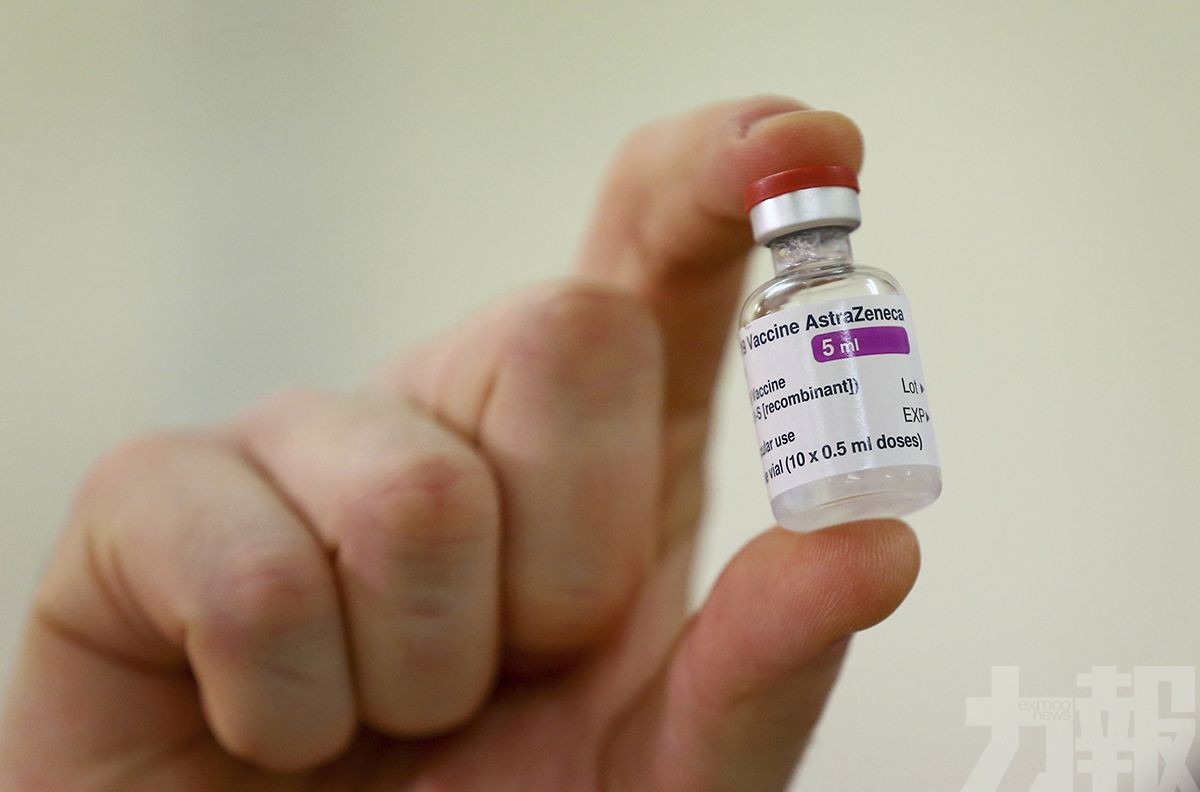
韓國食藥處計劃將疫苗審批時間由原先的180天以上縮短到40天以內。(AP圖片)
韓國食品醫藥品安全處(下稱:食藥處)今(4)日表示,已經受理並開始審查阿斯利康韓國公司新冠疫苗AZD1222的許可申報。食藥處計劃將疫苗審批時間由原先的180天以上縮短到40天以內。
據《韓聯社》報道,韓國食藥處表示,已著手審查非臨床和品質方面的材料,並要求阿斯利康韓國公司補充非臨床資料。阿斯利康韓國公司同時申請向韓國制藥商SK生物科技委託生產疫苗的製造、銷售許可和從義大利等國進口疫苗的進口許可。SK生物科技正向阿斯利康總公司額外提交委託生產疫苗的原液和成品的品質資料,阿斯利康總公司將在分析臨床試驗所用疫苗和委託生產疫苗品質是否相當後,向食藥處提交該資料。食藥處將在接手資料之前,先審查品質資料,以縮短審批周期。對疫苗接種者跟蹤觀察12個月所發現的異常反應也將以資料形式提交食藥處。
報道指,阿斯利康疫苗在2至4攝氏度的環境下存儲,將用於18歲及以上的成年人,分兩次接種,間隔時間4到12周。
阿斯利康疫苗的三期臨床試驗正在英國、巴西、美國等10多國進行。因去年9月出現無法解釋的疾病,阿斯利康曾暫停臨床試驗,但安全性審查認定該病例與疫苗並無直接關係,臨床試驗得以重啟。
英國在確認參與阿斯利康疫苗接種臨床試驗的1萬多人的預防效果後,於2020年12月30日批准其緊急使用授權。歐洲藥品管理局(EMA)去年10月起對該疫苗上市許可進行預審。阿斯利康還申請加入世界衛生組織的應急使用清單(EUL),推進全球供應計劃。(編輯:麥敏楨)